آشنایی با بیماری IBH در طیور
Inclusion body hepatitis
مروری بر بیماری IBH در طیور
دفتر بهداشت و مدیریت بیماریهای طیور، زنبور عسل و کرم ابریشم (سال 1399)
ترجمه و گردآوری : ابوالفضل رجب (D.V.M.PH.D)
مقدمه
آوی آدنوویروسها به طور گستردهای در گلههای تجاری جهان پراکنده بوده و گسترهی وسیعی از حدتها و علائم بالینی را نشان میدهند. عفونتهای آدنوویروسی با دامنهی وسیعی از علائم بالینی هپاتیتهای دارای گنجیدگی (IBH)، پنومونی و تراکئیت، خراش سنگدان، التهاب پیش معده و پانکراتیت در جوجهها میباشند. اهمیت حضور عفونتهای آدنوویروسی نه تنها به دلیل خسارات اقتصادی مرتبط با مرگ و میر (30-10 درصد) و کاهش راندمان است، بلکه ناشی از تأثیرات ویروس در تعامل با دیگر ویروسها نیز میباشد. برخی سویههای آدنوویروس منجر به کاهش شدید لنفوسیتها در بورس، تیموس و طحال میشوند که این خود کاهش ایمنی را در بر خواهد داشت.
آدنوویروس برای اولین بار در سال 1950 همراه با علائم کلینیکی در بلدرچین جداسازی شد. از آن زمان آدنوویروسها در تمام گونهها و نژادهای ماکیان و سایر پرندگان جداسازی شدند.
آدنوویروسهای مرغی دارای 12 سروتیپ هستند که به عنوان آلوده کنندههای ماکیان صنعتی شناخته میشوند و در 5 ژنوتیپ که با حروف A تا E مشخص میشوند، قرار میگیرند. در کشورهای مختلف در مورد حضور آدنوویروسها و سروتیپها و سویههای موجود، اپیدمولوژی، پاتوژنیسیته، میزان خسارت وارده تحقیقات بسیاری به عمل آمده است.
هپاتیت دارای گنجیدگی به عنوان یک بیماری مهم اقتصادی در جوجههای گوشتی 3 تا 6 هفتهای مطرح میباشد و عامل آن یک آدنوویروس است. بیماری با شروع ناگهانی مرگ و میر 10-1 درصد نشان داده شده ولی گاهاً به 40-30 درصد میرسد. سروتیپهای مختلفی از آدنوویروسهای پرندگان باعث عفونتهای IBH میشوند، به خصوص سروتیپهای مربوط به ژنوتیپهای E و D مسبب آسیبهای کبدی جدی متعاقب عفونت IBH هستند.
مطالعات و تحقیقات چند سال اخیر نشان داده است که این فرضیه که آدنوویروسهای ایجاد کننده بیماری IBH به عنوان عامل ثانویه هستند که بعد از بیماریهای تضعیف کننده سیستم ایمنی مانند گامبورو و یا CAV (بیماری کم خونی عفونی) بروز میکنند صحیح نبوده و آدنوویروسهای ایجاد کننده بیماری IBH به عنوان عامل اولیه پاتوژن به حساب میآیند و مطالعات مختلف در کشورهای کانادا، آمریکا، زلاندنو، استرالیا، لهستان مؤید این مطلب بوده است.
طبقه بندی سویه ها
هگزون به عنوان مهمترین پروتئین کپسید آدنوویروس محسوب میشود و دارای تیپ، گروه و تحت گروه اختصاصی شاخص آنتی ژن است که آنتیبادی اختصاصی علیه آن ساخته میشود. شاخص اختصاصی گروه توسط آوی آدنوویروس عرضه میشود، اما توسطSiadenovirus و Atadenovirus ارائه نمیشود. شاخصهای اختصاصی که موجب تولید آنتی بادی میشوند، میتوانند موجب خنثی کردن عفونت زایی ویروس شوند، بنابراین از آزمون خنثی سازی به صورت رایج برای تشخیص سروتیپها استفاده میشود.
طبقه بندی بر اساس ایمنی زایی و خصوصیات محافظت کننده
آنتی بادیهای خنثی کننده که بر ضد اپی توپهای اختصاصی ویروس تولید میشود موجب محافظت میشوند. اما اطلاعات در مورد گسترش اپی توپها و مدت ایمنی محدود است.
طبقه بندی
تعیین گونه در خانواده آدنوویروسها به وجود حداقل دو معیار وابسته است که شامل محاسبه فاصله تبارشناختی، قطعات آنزیم محدود کننده، میزبان، پاتوژنیسیته، خنثی سازی متقاطع و توانایی نو ترکیبی ژنی میباشد. در جنس Aviadenovirus (آدنو- ویروسهای پرندگان) 5 گونه وجود دارد که با حروف A تا E مشخص میشوند و بر اساس الگوهای مولکولی قطعات آنزیم محدود کننده و توالی ژنی تقسیم میشوند.
تا کنون توالی نوکلئوتیدی ژنهای FAdV-C, FAdV-D, FAdV-A و FAdV-E به صورت کامل شناسایی شده است، که توانایی مطالعات کامل فیلوژنیک گونههای مختلف آدنوویروس را با میزان تشخیص نوکلئوتیدی 52 تا 72 درصد به ما می دهد. ویروسهای یک گونه نیز میتوانند با آزمون خنثی سازی متقاطع به سروتیپ و ژنوتیپ تقسیم شوند.
بر اساس تقسیم بندیهای صورت گرفته، آدنوویروس مرغی گونهی A شامل سروتیپ یک (FAdV-1 یا ویروس CELO)، گونهی B شامل سروتیپ پنج (FAdV-5)، گونهی C شامل سروتیپهای چهار و ده (FAdV-10 , FAdV-4)، گونهی D شامل سروتیپهای دو، سه، نه و یازده (FAdV-11 , FAdV-9, FAd-3, FAdV-2) و گونهی E شامل سروتیپهای شش، هفت، هشت آ و هشت ب
(FAdV8b- FAdV8a- FAdV7- FAdV6) میباشند.
DIFFERENT SPECIES (CENOTYPES) AND
SEROTYPES OF AVIAN ADENOVIRUSES
Fowl Adenovirus A
Serotypes : Fowl adenovirus 1 (FAdV-1)
Fowl Adenovirus B
Serotypes : Fowl adenovirus 5 (FAdV-5)
Fowl Adenovirus C
Serotypes : Fowl adenovirus 4 (FAdV-4)
Fowl adenovirus 10 (FAdV-10)
Fowl Adenovirus D
Serotypes :
Fowl adenovirus 2 (FAdV-2)
Fowl adenovirus 3 (FAdV-3)
Fowl adenovirus 9 (FAdV-9)
Fowl adenovirus 11 (FAdV-11)
Fowl Adenovirus E
Serotypes :
Fowl adenovirus 6 (FAdV-6)
Fowl adenovirus 7 (FAdV-7)
Fowl adenovirus 8a (FAdV-8a)
Fowl adenovirus 8b (FAdV-8b)
There are 12 recognized serotypes in the five genotypes.
تاریخچه
به دنبال اولین گزارش جداسازی آدنوویروس پرندگان در سال 1950، در دهههای اخیر جداسازی آدنوویروس از پرندههای سالم و بیمار در مناطق جغرافیایی مختلف با استفاده از آزمون خنثی سازی متقاطع صورت گرفت. در سالهای اخیر نشان داده شد که ویروس بیماری بورس عفونی و ویروس کم خونی عفونی جوجهها (CIAV) می توانند حدت ویروس FAdV را افزایش دهند. بعدها مطالعات تجربی و فیلدی نقش اولیه FAdV را در ایجاد عفونتی خاص، وابسته به حدت آن اثبات کرد.
آسیب شناسی و همه گیر شناسی
وقوع و گسترش
FAdV در سراسر جهان گسترش دارد و در تمام گونههای طیور اهلی و در تمام سنین مشاهده می شود. سایر گونه های پرنده نسبت به عفونت FAdV حساس هستند، ولی این موضوع به صورت کامل بررسی نشده است.
اهمیت اقتصادی
با توجه به متنوع و زیاد بودن بیماریهای ناشی از آدنوویروسها به خصوص FAdV، بیان اهمیت اقتصادی آن مشکل است. با این وجود، تلفات بالا در درگیری با سویههای حاد FAdV-4 و عقب ماندگی از رشد در عفونت های IBH و ساییدگی سنگدان خسارات اقتصادی زیادی را به دنبال دارد.
تکثیر ویروس
تکثیر آدنوویروس به 2 مرحله تقسیم می شود؛ مرحله اول با ورود ویروس به داخل سلول میزبان و انتقال DNA ویروس به هسته سلول است و به دنبال آن رونویسی و ترجمه ژنهای زودهنگام. به دنبال تولید پروتئینهای ژنهای زودهنگام، عملکرد سلول برای تکثیر DNA ویروس تغییر کرده و موجب رونویسی و ترجمه ژن های دیرهنگام و تولید پروتئین های ساختاری ویروس می شود.
تجمع پروتئین های ویروس به شکل ویریون در داخل هسته سلول میزبان انجام شده و با تخریب غشای هسته و سلول، ویروس آزاد می شود؛ اگرچه این اطلاعات بیش تر از آدنوویروس های پستانداران اخذ شده و FAdV از نظر کد کردن ژن های اولیه تکثیر با بقیه آدنوویروس ها متفاوت است.
بیماری زایی
به دلیل این که نقش FAdV به عنوان پاتوژن اولیه به روشنی شناخته نشده است، فاکتورهای تعیین کننده پاتوژنیسیته هنوز به طور کامل شناخته نشده اند. سروتیپ های مختلف و سویههای متفاوت آن ها میتواند بیماری و میزان مرگ و میر مختلفی را ایجاد کند. توانایی بقا و رشد آن در تاندون جنین جوجه مورد مطالعه قرار گرفته است. در بعضی از جدایهها ارتباط بین حدت و ژنوتیپ پیدا شده ولی بین سروتیپ و حدت پیدا نشده است. در مقایسه با سایر سویهها، FAdV-1 میتواند در همستر ایجاد تومور کند و سلولهای انسان و همستر را تغییر دهد.
در بسیاری از مطالعات نحوه تلقیح، سن پرنده و دوز ویروس به عنوان عوامل مهم در ایجاد بیماری محسوب شدهاند. بسیاری از سروتیپها در صورت انتقال به روش معمول بیماری زا نیستند اما در خصوص تزریق عامل، بسیار حاد و بیماری زا هستند. یکی از خصوصیات سویههای بسیار حاد FAdV این است که در صورت ایجاد عفونت به روش دهانی یا چشم و بینی تلفات بالایی ایجاد می کنند.
عفونت هم زمان با بیماری گامبورو و کم خونی عفونی جوجه موجب افزایش بیماری زایی بعضی از سویه های FAdV می شوند. در مقایسه با آن، حضور هم زمان پاروویروس و آدنوویروس در محیط کشت سلولی موجب کاهش بیماری زایی و عفونت زایی آن می شود.
متعاقب آلودگی تجربی جوجه های SPF در اولین روزهای زندگی، از طریق روشهای معمول، در ابتدا آدنوویروسها در اپی تلیوم روده باریک و بزرگ رشد میکنند. سپس ویرمی و بعد رونوشت برداری ویروس در خیلی از اندامها مثل کبد، دستگاه تنفس، بورس، طحال و مغز استخوان رخ میدهد. ولی در شرایط مزرعه عفونت با آدنوویروسها در در خلال چند روز اول زندگی مشخص نمی شود. بنابراین در انگلستان جدا کردن آدنوویروس طی هفته اول زندگی جوجههای گوشتی غیرمعمول است. ولی به طور معمول از سه هفتگی به بعد احتمال جدا کردن آدنوویروسها از جوجهها وجود دارد. در این ارتباط ویروس به سهولت از مدفوع، موکوس چشم و بینی و بورس جدا میشود. بندرت ممکن است آدنوویروسها را از اندامهای داخلی پرندگان سالم جدا کنند و در این موارد معمولاً ویرمی رخ نداده است. در عفونت طبیعی با آدنوویروسها، ویروس در حدود 3 هفته از طریق مدفوع به محیط دفع می شود و اوج دفع ویروس از روز چهارم تا هفتم بعد از آلودگی خواهد بود. بنابراین در پرندگان بیمار، آدنوویروس اغلب از اندامهای داخلی قابل جدا کردن است. در این موارد مشخص نیست که آدنوویروس به عنوان عامل اولیه بیماری، عامل بیماریزای ثانوی و یا یک همزیست در بافت آلوده است.
ماکیان آلوده به آدنوویروسها در تمام طول زندگی حامل ویروس خواهند بود. حاملین ویروس احتمالاً در تمام طول زندگی در فواصل زمانی ویروس را به محیط دفع می کنند. فعالیت مجدد ویروس نهفته باعث فراخوانی مجدد آنتی بادی میشود، و اگر پرنده در حال تخمگذاری باشد ویروس از طریق تخم مرغ نیز دفع خواهد شد. در مزرعه ممکن است ماکیان به طور همزمان با بیش از یک سروتیپ از آدنوویروس ها آلوده شوند.
آسیب شناسی
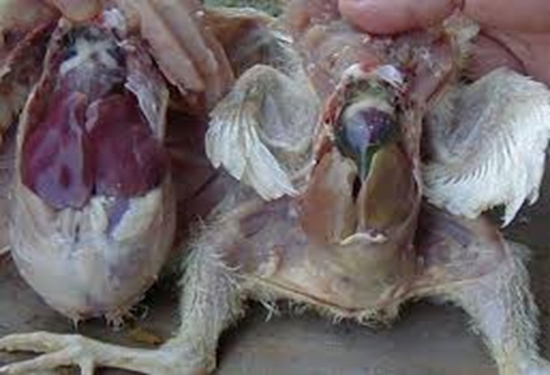
اولین مکانی که در این بیماری تحت تأثیر قرار می گیرد، کبد است. اما ممکن است آسیب به سیستم خون ساز نیز دیده شود. آنمی آپلاستیک دیده شده احتمالاً به دلیل عفونت با ویروس کم خونی عفونی جوجه بوده است. در بیماری IBH، کبد کم رنگ، شکننده و متورم است. نقاط کوچک سفید و نقاط پتشی و اکیموز و خون ریزی نیز می تواند در کبد مشاهده شود.
گنجیدگیها در هپاتوسیتها، میتواند ائوزینوفیلیک و بزرگ و گرد با کنارههای کم رنگ و در بعضی مواقع بازوفیلیک باشد.
اجزای ویروسی فقط در سلول هایی دیده می شود که دارای گنجیدگی های بازوفیلیک باشد و در سلولهایی که دارای گنجیدگیهای بازوفیلیک باشد و در سلولهایی که دارای گنجیدگیهایی که ائوزینوفیلیک باشند به شکل گرانول یا رشته ای دیده می شود. جراحاتی مانند آتروفی بورس فابرسیوس و تیموس، آپلازی مغز استخوان و هپاتیت در این بیماری دیده می شود. در طی بررسی های هیستومورفومتریک، گلومرولونفریت نیز در درگیری با IBH مشاهده شده است.
سندرم هیدروپری کاردیوم (HS)
در موارد درگیری با سندرم هیدروپری کاردیوم، تجمع مایع شفاف و به رنگ کاهی در کیسه پری کارد قلب، ادم ریوی، کبد رنگ پریده و متورم و کلیه بزرگ با دژنراسیون توبولها دیده میشود. (خون ریزیهای پتشی و نقاط نکروزه به همراه نفوذ سلولهای تک هستهای در کبد و قلب مشاهده می شود). در هپاتوسیتها گنجیدگیهای بازوفیلیک قابل رؤیت است. بر اساس گزارشی، سندرم هیدروپری کاردیوم به همراه نکروز نقطهای پانکراس و زخم سنگدان مشاهده شد. درگیری با این ویروس می تواند منجر به تضعیف ایمنی شدید با تخلیه لنفوسیت های B و T از عقده های لنفاوی گردد.
بیماری تنفسی
التهاب نزلهای نای به همراه افزایش ترشحات موکوسی از علایم تنفسی رایج درگیری با این ویروس است. پرخونی ریه به همراه افزایش ضخامت دیواره نای به دنبال عفونت دیده میشود. جراحات میکروسکوپی شامل از بین رفتن مژه ها، نکروز سلولهای اپی تلیال، گنجیدگی داخل هستهای و ارتشاح گلبولهای سفید تک هستهای به لایه لامینا پروپیا میباشند. پنومونی بینابینی نیز گاهی اوقات دیده میشود. جراحات میکروسکوپی شامل از بین رفتن مژه ها، نکروز سلولهای اپی تلیال، گنجیدگیهای داخل هستهای و ارتشاح پنومونی بینابینی نیز گاهی اوقات دیده می شود.
پانکراتیت نکرونیک و زخم سنگدان
پانکراتیت کانونی و زخم سنگدان در عفونت مرغ گوشتی در ژاپن گزارش شده است. گنجیدگیهای داخل هستهای در سلولهای گلانورلار سلولهای اپی تلیال حاوی آنتی ژن های آدنوویروس به همراه نکروز لایه کوئیلین و ارتشاح ماکروفاژ و لنفوسیت در لایهی لامینا پروپیا و عضلانی مشاهده میشود. گنجیدگیهای داخل هستهای در سلولهای آسینی پانکراس دیده میشود. پانکراتیت و زخم سنگدان ناشی از آدنوویروس در مرغ شاخدار نیز گزارش شده است.
بیماری
این موضوع بسیار مورد تأکید است که آدنوویروسها انتشار بسیار وسیعی در پرندگان سالم دارند و به طور معمول در تمام سیستمهای مدیریتی جدا میشوند. این بدان معنا نیست که آدنوویروسها باعث بیماری نمیشوند ولی بدان معناست که جدا کردن آدنوویروس از یک پرنده بیمار نمیتواند ما را به این نتیجه برساند که این ویروس باعث بیماری گشته است.
آدنوویروس ها در واقع از همه موارد بالینی جدا می شوند. ولی اینها عمدتاً با هپاتیت همراه با گنجیدگیهای داخل سلولی، بیماریهای تنفسی، کاهش تولید تخم مرغ، اسهال، تنوسینوویت، کاهش رشد و افزایش ضریب تبدیل غذایی ارتباط دارند. نوعی آدنوویروس که باعث بیماری ای با نشانه های پانکراتیت، کم خونی و تخلیه بورس و طحال از لنفوسیت ها می شود جدا شده است. در گزارش اخیر همچنین بیان شده است که آلودگی با آدنوویروس ها در طیور گوشتی باعث افزایش چربی در مزانترها می شود.
سن میزبان
برخی از ویروسها در جوجه یک روزه میتوانند موجب تلفات شوند، اما در جوجههای 10 روزه اتفاقی نمی افتد. حدت ویروس به سویه ویروس، نحوه ورود، سن پرنده و میزان عامل عفونی مرتبط می باشد.
دوران کمون
دوران کمون به دنبال انتقال طبیعی عامل کوتاه (24 تا 48 ساعت) است.
نشانه های بالینی
هپاتیت همراه با گنجیدگی با شروع ناگهانی تلفات که حداکثر آن بعد از 3-4 روز است و معمولاً روز پنجم کاهش می یابد، مشخص می شود اما گاهی 2 هفته ادامه می یابد. تلفات ممکن است به 10% برسد و گاهی اوقات تا 30% هم افزایش می یابد. معمولاً در جوجه های گوشتی 3-7 هفته مشاهده می شود اما در پرندگان کمتر از 7 روز و بیشتر از 20 هفته هم گزارش شده است. میزان ابتلا کم است و پرندگان مبتلا، حالت قوز کردن و ژولیدگی پرها را نشان می دهند و در عرض 48 ساعت تلف می شوند یا بهبود پیدا می کنند. پرندگان دیگر در گله معمولاً سالم به نظر می رسند یا ممکن است برای چند روزی بی حال باشند. تبدیل غذایی و وزن گیری، معمولاً کاهش می یابند.
جراحات کالبد گشائی
طیور تلف شده اغلب در وضعیت خوب بوده که نشان دهنده دوره کوتاه بیماری است. در روی لاشه کم خونی عمومی اغلب همراه با خونریزی در عضلات سینه و ران و در تمام چربیهای بدن و اندامهای داخلی دیده میشود. کبد بزرگ، متورم و کمرنگ با تظاهر چربی و خونریزی روی آن است. گاهی لکههای نکروتیک نیز روی آن دیده میشود. بطور کلی تغییرات متفاوتی در کبد طیور مشاهده میشود. کلیه بزرگ، بی رنگ با نقاط خونریزی زیر کپسول و کریستالهای شبیه اورات و مغز استخوان چرب زرد رنگ و کم خون است. گاهی آب آوردگی پرده قلب مشاهده میشود. کیسه فابریسیوس کوچکتر از حد معمول (3/1 اندازه طبیعی) است که شاید این حالت به علت آلودگی قبلی با بیماری گامبورو باشد. میزان گلبول قرمز به 0/5 تا 1/10 اندازه طبیعی میرسد. طحال با اندازه متفاوت، بی رنگ و تظاهر دان دان دیده میشود. در پیش معده بخصوص در محل اتصال به سنگدان نقاط خونریزی پراکنده موجود بوده که این نقاط در زیر مخاط سنگدان گاهی کشیده شده و باعث تیرگی محل شده و گاهی باعث افتادن غشاء سنگدان میشود. در غشاء سروزی و موکوسی رودهها نیز گاهی لکههای خونریزی دیده میشود. در بعضی اشکال بیماری فقط علائم کم خونی بدون تغییرات کبد دیده میشود. در آزمایشات ریزبینی بیشتر جراحات در مغز استخوان، کبد، کلیه و بورس فابریسیوس است. در مغز استخوان بیشتر بافت چربی و سلولهای مزانشیمی دیده میشود. در بافت کبد نقاط نکروز دیده که با گلبولهای قرمز و گاهی همراه با سلولهای ماکروفاژ و لمفوسیت پر شدهاند.
در بعضی از واگیری ها، جراحات مغز استخوان بسیار قابل توجه است که باریک و آبکی می شود.
بیماری تنفسی
آدنوویروسها غالباً از کیسههای هوایی، ریهها و نای پرندگان مبتلا به بیماری تنفسی جدا میشوند. برای ایجاد بیماری تجربی در پرندگان، موفقیتهای متنوعی گزارش شده است. چنین تصور نمیشود که آدنوویروسها عاملین اولیه بیماریهای تنفسی باشند ولی در شرایطی که پرنده تحت تأثیر بیماری IBD و یا اسپری غلط واکسن IB در یکروزگی دچار تضعیف سیستم ایمنی شده باشد، آدنوویروسها به عنوان عامل ثانوی در قسمتهای پایینی دستگاه تنفس منجر به بیماری خواهند شد. التهاب خفیف تا متوسط نای همراه با افزایش ترشحات موکوسی، تنها آثار کالبدگشایی هستند.
آرتریت ویروسی/ تنوسینوویت
آرتریت، التهاب مفصل و تنوسینوویت، التهاب غلاف تاندون است. آدنوویروس ها معمولاً از مفصل یا تاندون های پرندگان دچار آرتریت و تنوسینوویت جدا می شوند. اما نقش دقیق آنها مشخص نشده است.
اثر بر رشد و تبدیل غذایی
گزارش نشان داده، که عفونت آدنوویروس سبب کاهش مصرف غذا می شود و البته شواهدی نیز وجود دارد که نشان می دهد عفونت های طبیعی سبب کاهش مصرف غذا و رشد می شوند.
کاهش تولید تخم مرغ
طبق گزارشها، عفونت آدنوویروسی سبب افت تولید 10 درصدی می شود و یا روی کیفیت پوسته تخم مرغ تأثیر میگذارد. آدنوویروسها را میتوان از گلههای تجاری، زمانی که در بالاترین حد تولید و نطفه داری خود قرار دارد، جدا کرد. مواجه گله تخم گذار با یک آدنوویروس ممکن است سبب کاهش تولید تخم مرغ شود. البته در اکثر نظامهای مدیریتی امکان ندارد که پرنده به سن بلوغ جنسی برسد، بدون اینکه با تعداد زیادی از آدنوویروسها آلوده نشده باشد. به نظر میرسد افت تولید تخممرغ به وسیله آدنوویروسها در ماکیان، چندان اهمیت ندارد.
انتشار
1- آدنوویروسها از راه تخم مرغ منتقل می شوند. انتقال عمودی، اهمیت زیادی دارد زیرا راه اصلی انتشار از نسلی به نسل دیگر است. سپس انتقال افقی از طریق تماس با مدفوع آلوده اتفاق میافتد. در عفونتهای طبیعی، حدوداً 3 هفته آدنوویروس در مدفوع دفع میشود و حداکثر میزان دفع آن بین 4-7 روزگی است. در گزارش دیگری مشاهده شده است که آدنوویروسها از 3 هفتگی به بعد دفع میشوند و در گله گوشتی حداکثر دفع بین 4-6 هفتگی اتفاق می افتد. در گله های تخم گذار، دفع ویروس از 5-9 هفتگی به حداکثر مقدار خود می رسد و بعد از 14 هفتگی هم هنوز 70% است. ماکیان آلوده به آدنوویروسها، پتانسیل تبدیل شدن به پرنده حامل را دارند که این پرندگان احتمالاً ویروس را به صورت متناوب در طول زندگی خود دفع می کنند.
2. در صورت آلودگی با آدنوویروسها، معمولاً یک مرحله ثانویه دفع ویروس هم در زمان اوج تولید (پیک تولید) وجود دارد. تنش تولید یا سطوح بالای هورمونهای جنسی، منجر به فعال شدن مجدد ویروسهای نهفته میشوند و ویروس از طریق تخممرغ منتقل خواهد شد. بدین ترتیب انتقال ویروس از نسلی به نسل بعد حداکثر مقدار خود می رسد.
3. انتشار افقی ویروس هم اهمیت دارد. ویروس در مدفوع و پوشش مخاطی بینی و کلیه ها و در همه ترشحات بدن حضور دارد. اما بیشترین میزان آن در مدفوع یافت شده است. انتقال افقی عمدتاً از طریق تماس مستقیم با مدفوع صورت می گیرد.
4. انتشار از طریق هوا، اهمیتی ندارد مگر اینکه پرندگان با ارگانیسم های بیماری زایی که سبب تنگی نفس می شوند مانند ویروس برونشیت عفونی، آلوده شوند که این تنها موردی است که انتشار از طریق هوا در آن مؤثر خواهد بود.
5. انتشار ممکن است از طریق مواد یا اشخاص و وسایل حمل و نقل آلوده به ویروس، انجام شود زیرا آدنوویروس ها در بیرون از بدن پرنده، نسبت به غیر فعال شدن، نسبتاً مقاوم هستند.
6. زمانی که آنتی بادی مادری کاهش پیدا می کند، دفع ویروس شروع می شود و جوجه هایی که در تماس با آنها هستند را آلوده می کند.
نحوه انتقال و حاملین
انتقال عمودی یکی از مهم ترین راه ها در گسترش FAdV است. آنتی ژنهای ویروس را می توان در زرده و سفیده تخم مرغ جنین دار تشخیص داد و ویروسهای جدا شده از مرغ آلوده در صورت انتقال به محیط کشت سلولی دوباره فعال خواهند شد.
این عامل یکی از مهم ترین موانع در ایجاد گلههای عاری از پاتوژن اختصاصی است. مدارکی مبنی بر عفونت مخفی توسط آدنوویروسها وجود دارد و میتواند برای یک نسل در گلههای عاری از پاتوژن اختصاصی تشخیص داده نشود. اگرچه FAdV را میتوان از جوجه یک روزه نیز جدا کرد، اما معمولاً از هفته 3 به بعد جدا می شود. در مرغهای گوشتی بیش ترین میزان دفع ویروس بین 4 تا 6 هفتگی است.
در گله های تخمگذار جایگزین، بیش ترین میزان دفع ویروس بین 4 تا 9 هفته بعد از عفونت است، اما پس از 14 هفته میزان دفع به 70 درصد می رسد؛ به طوری که در مطالعهای 6 سروتیپ آدنوویروس از مزرعه نمونه برداری جدا شد. در یک مطالعه که از جوجههای 8 روزه شروع به بررسی شد، تا 14 هفته بیشترین میزان دفع ویروس را نشان دادند و از 7 مزرعه آلوده 8 سروتیپ متفاوت جدا شد. معمولاً از یک مرغ آلوده نمیتوان هم زمان چند سروتیپ مختلف ویروس را جدا کرد، چرا که احتمال وجود ایمنی متقاطع در صورت تولید آنتی بادیهای خنثی کننده برای یک سروتیپ وجود دارد و مانع از تکثیر سایر سروتیپها می گردد. در پیک تولید تخم مرغ نیز اغلب FAdV تشخیص داده می شود. احتمالاً استرس تولید تخم مرغ یا افزایش میزان هورمون های جنسی در این زمان، موجب فعال شدن مجدد ویروس و افزایش انتقال آن به نسل بعد می شود.
انتقال افقی ویروس نیز مهم است. ویروس میتواند در مدفوع، مخاط نای و بینی و کلیه وجود داشته باشد. بنابراین ویروس میتواند از راههای مختلفی دفع شود، ولی مدفوع دارای بیشترین میزان ویروس است. ویروس هم چنین میتواند در مایع منی حضور داشته باشد که خطر تلقیح مصنوعی را بالا میبرد. به دنبال عفونت دهانی جوجههای 1 روزه یا 4 هفتهای میزان دفع متفاوت است. مرغهای مسن میزان کمتری از ویروس را از طریق مدفوع دفع میکنند و مدت دفع ویروس نیز کوتاهتر است. انتقال افقی در داخل گله بیشتر به وسیله تماس مستقیم با مدفوع است، اما میتواند از طریق تنفسی نیز از راه نزدیک منتقل شود. سرعت انتقال و گسترش عفونت نیز در گله آرام بوده و چندین هفته طول میکشد. این الگوی انتقال در گلههای آلوده به صورت نابهجا در جوجههای عاری از پاتوژن اختصاصی نیز دیده میشود و این گلهها آدنوویروس را دفع میکنند. در چنین شرایطی، احتمال حضور کانونهای زیادی از عفونت به دلیل فعال شدن مجدد ویروسهای قرار گرفته در فاز مخفی وجود خواهد داشت. گلههای گوشتی تجاری ممکن است از گلههای مادر مختلفی باشند که هر کدام از آنها دارای سروتیپ مختلفی از FAdV میباشند. در نتیجه وقتی این جوجهها کنار هم جمع میشوند، موجب ایجاد عفونت متقاطع با چندین سروتیپ میشوند. انتقال از طریق هوا بین دو مزرعه اهمیت زیادی ندارد، غیر از زمان پایان دوره و تخلیه که میتواند از طریق گرد و غبار بین دو مزرعه منتقل شود. انتقال میتواند از طریق کارکنان و وسایل حمل و نقل، سینیها و گاریهای حمل تخم مرغ انجام گیرد.
تشخیص
تشخیص و جداسازی آوی آدنوویروسها
نمونههای انتخابی برای جداسازی ویروس، مدفوع، سکال تانسیل، حلق، کلیه و اندامهای آلوده (مانند کلیه در IBH) میباشد. سوسپانسیون 10 درصد از بافت مورد نظر در مورد FAdV در بافتهای کبد جنین مرغی، سلولهای کلیه جوجه یا LMH کشت داده میشود. اگر تلاش برای جداسازی ویروس از سایر گونههای پرنده صورت میگیرد، میتوان از کشت سلولی آن پرنده یا کشت سلول مرغ استفاده کرد. تخم مرغهای جنیندار برای جداسازی اولیه آدنوویروس مناسب نیست و میتواند در کیسه زرده و غشای کوریو آلانتوئیک ایجاد عفونت کند، بنابراین توصیه میشود از آن به عنوان روش جایگزین در آزمایشگاه در صورت نبود محیط کشت سلولی استفاده شود.
تأیید آدنوویروس جدا شده میتواند با استفاده از میکروسکوپ الکترونی انجام شود. ایمونوسیتوشیمی نیز میتواند برای تشخیص آدنوویروسها در سلولهای آلوده با استفاده از آنتی سرم آدنوویروس رنگ آمیزی شده با ایمونوفلورسانس به کار برده شود. برای تشخیص سروتیپ آدنوویروس جدا شده میتوان از آزمون خنثیسازی ویروس با استفاده از آنتی سرمهای استاندارد استفاده کرد. آزمون PCR که از اختلاف نوکلئوتید لوپ 1 در ژن هگزون برای تشخیص و تفریق ژنوتیپها که با سروتیپها نیز هم خوانی دارد، استفاده میکند امروزه جایگزین روشهای دیگر تشخیص شده است.
PCR Real time و Nested PCR آزمونهای مفید و حساسی برای مقایسه سروتیپ های ویروس به شمار میآیند. تشخیص DNA آدنوویروس در نمونههای بافتی با استفاده از آزمون in situ hybridization گزارش شده است. طراحی پراب تأثیر زیادی در حساسیت و اختصاصیت دارد. اگر هیچ کدام از این تکنیکهای تشخیصی در دسترس نبودند، میتوان با رنگ آمیزی H&E در سلولهای آلوده مقاطع بافتی با دیدن گنجیدگیهای بازوفیلی داخل هسته به یک تشخیص غیر اختصاصی و وجود ویروس حاوی DNA پی برد.
سرولوژی
با آزمون دابل ایمونودیفیوژن میتوان آنتی بادیهای اختصاصی گروه را تشخیص داد. آزمونهای الایزا و ایمونوفلورسانس غیرمستقیم بسیار حساستر از آزمون دابل ایمونودیفیوژن میباشد. اما نتایج بستگی به آنتی ژن استفاده شده در آزمایش دارد. الایزا برای تشخیص آنتی بادیهای اختصاصی گروه استفاده میشود و یک آزمون ارزان و حساس است. به طور معمول از آزمون خنثیسازی سرم برای تشخیص آنتیبادیهای اختصاصی تیپ استفاده میشود، اما میتوان از الایزا نیز به این منظور استفاده کرد، اگرچه وجود سروتیپهای مختلف ممکن است ایجاد اختلال کند. وجود آنتیبادیهای هومورال نشان دهنده وضعیت ایمنی موضعی و مخاطی نیست.
سیستم آزمایشگاهی میزبان
بسیاری از سروتیپهای آدنوویروس جوجه در سلول کلیه جوجه و سلولهای جنینی جوجه رشد میکنند. رده سلولهای کبدی جوجه میتواند برای جداسازی و تکثیر FAdV استفاده شود. علاوه بر این، کشت بافت نای جوجه و فیبروبلاستهای جنین جوجه حساسیت کمتری را نسبت به بقیه سلولها دارند. هم چنین رده سلولی فیبروبلاستهای بلدرچین (QT35) میتواند نسبت به ویروس حاد FAdV-4 سازگار شود.
آوی آدنوویروس تا کنون از بوقلمون، غاز، اردک و کبوتر جدا شده است. گزارشات مختلفی مبنی بر حضور FAdV در گونههای مختلف پرندگان مانند طوطی و پرندگان شکاری و وحشی وجود دارد. در صورت انجام آزمایش بر روی گونههای مختلف با استفاده از سیستمهای سلولی هومولوگ، امکان شناسایی محدوده وسیعی از ویروسها وجود خواهد داشت. همچنین این احتمال وجود دارد که همه آوی آدنوویروسهایی که در تخممرغ جنیندار تکثیر مییابند، در جوجه و بوقلمون جراحت ایجاد نکنند. تفاوتهای زیادی بین سویههای مختلف FAdV در ایجاد جراحات و تلفات وجود دارد. کیسه زرده در مقایسه با کیسه آلانتوئیک حساسیت بیشتری دارد و میزان بیشتری از ویروس را نشان میدهد. در بررسی دیگری کیسه آلانتوئیک حساسیت کم تری را نسبت به غشای کوریوآلانتوئیک نشان داد، که می تواند برای نشان دادن حساسیت جنین نسبت به FAdV-1 به کار برده می شود.
علایم و جراحات در جنین شامل مرگ و میر، عقب ماندن از رشد و هپاتیت، اسپلنومگالی، احتقان و خون ریزی سراسر بدن و تجمع اورات در کلیهها است. هپاتوسیتها معمولاً دارای گنجیدگیهای داخل هستهای بازوفیلیک و ائوزینوفیلیک میباشند. هیچ ارتباطی بین مرگ و میر بالای جنین و علایم بالینی در جوجههای یک روزه عاری از پاتوژن آلوده شده به ویروس وجود ندارد.
وضعیت بیماری IBH در دنیا
در کشور استرالیا دو سروتیپ FAdV-8b و FAdV11 باعث شیوع بیماری IBH می باشند و به عنوان عامل بیماری شناخته می شوند.
در کشور زلاندنو سروتیپ FAdV-8 به عنوان عامل بیماری IBH گزارش گردیده است.
در کشور کانادا در گله های گوشتی سروتیپ های FAdV-7 و FAdV-8a و FAdV-8b و FAdV-11 به عنوان سروتیپ های ایجاد کننده بیماری IBH از گله های مبتلا به بیماری جداسازی شده اند.
در کشور لهستان از گله های طیور مبتلا سروتیپ های FAdV-1 و FAdV-8a در سال 2018 جداسازی گردید.
در کشور لبنان در سال 2017 سروتیپ FAdV-8b و FAdV-11 از گله های گوشتی جداسازی گردید.
در کشورهای کویت و عراق از سروتیپ FAdV-4 به عنوان عامل بیماری IBH ذکر گردیده است.
در کشور شیلی سروتیپ FAdV-4 به عنوان عامل بیماری IBH شناسایی شده است.
در کشور ژاپن سروتیپ اصلی ایجاد کننده بیماری IBH سروتیپ FAdV-2 بوده و بعد از آن سروتیپ FAdV-11 مسبب بیماری IBH می باشد.
در کشور چین بر اساس آخرین مطالعه انجام شده در سال 2016 سروتیپ های FAdV-4 ، FAdV-8 ، FAdV-8b و FAdV-11 به عنوان سروتیپ های مسبب بیماری IBH در این کشور شناخته شده اند.
در کشور کره جنوبی سروتیپ های FAdV-3، FAdV-4، FAdV-9، FAdV-11 به عنوان عامل بیماری IBH در این کشور شناسایی شده اند.
در کشور پاکستان عامل اصلی سندروم هیدروپریکاردیوم یا HS سروتیپ FAdV-4 گزارش گردیده است.
در کشور هندوستان در سال 2016 سروتیپ FAdV-2، FAdV-4، FAdV-8، FAdV-11 از
گله های گوشتی جداسازی گردیده است.
در سال 2019 وقوع بیماری IBH ناشی از سروتیپ FAdV-11 در گله های گوشتی کشور مراکش گزارش گردید.
در سال 2020 وقوع بیماری ناشی از سروتیپ های FAdV-8b و FAdV-11 در گله های گوشتی و گله های مادر گوشتی در کشور ترکیه برای اولین بار گزارش گردید.
ردیابی مولکولی آدنوویروسهای پرندگان در گلههای ماکیان گوشتی مشکوک به گنجیدگی درون هسته ای (IBH) در ایران
در ارتباط با ردیابی مولکولی، شیوع آدنوویروس مرغی در ایران طی چند سال اخیر، مطالعاتی در برخی از استانها، از جمله : گلستان، خراسان رضوی، اصفهان، فارس، قم،مرکزی، کرمانشاه و خوزستان انجام گرفته است. مطالعه آلودگی آدنوویروس در استان قم توسط وفایی و حسینی در سال 1392 انجام شد و میزان آلودگی در این استان را 8/8 درصد گزارش کردند. در مطالعهی قربیانی در سال 2016، پس از انجام PCR بر روی 69 نمونهی کبد جمع آوری شده از استان اصفهان، میزان آلودگی به ویروس عامل IBH، 25/7 درصد گزارش گردید. بر اساس این گزارش ، رابطه ی معنی داری بین سن و میزان موارد مثبت و منفی مشاهده نشد و موارد مثبت به دست آمده در این مطالعه در سنین 10 تا 32 روزگی بوده است. تلفات بعد از این سن با وجود جراحت های بارز کبدی از نظر مولکولی منفی بودند. طبیب غفاری و همکاران در سال 2017 نیز نمونه های کبد اخذ شده از کشتارگاه صنعتی استان خوزستان را از نظر بیماری IBH مورد بررسی مولکولی قرار دادند و بیان داشتند که نبود نمونه ی مثبت در سنین کشتار این احتمال را ایجاد می کند که ممکن است در سنین پایین تر عفونت هایی از آدنوویروس ماکیان در این گله ها وجود داشته و بعد از مدتی به حالت نهفته تبدیل شده باشند. در خصوص این که چه مدت پس از چالش، ویروس در کبد ماکیان قابل تشخیص است مطالعه کامل و قابل استنادی در دسترس نمی باشد.
ناطقی و همکاران در سال 2014 در بررسی 60 نمونهی بافتی حاصل از مراجعات درمانگاهی میزان آلودگی آدنوویروس را در شمال شرق ایران 10 درصد (6 مورد، شامل 5 نمونهی مثبت از کبدهای مشکوک و 1 نمونه ی مثبت از ریههای جمع آوری شده) گزارش نمودند.
در مطالعهی حسینی و همکاران در سال 2012، حضور آدنوویروس مرغی در همهی 20 نمونهی کبد بررسی شده تأیید گشت. نمونهها از 2 گلهی گوشتی در سنین زیر 3 هفتگی، بدون هیچ گونه علائم بالینی و با تلفات 30-20 درصد گرفته شده بودند. از نظر جغرافیایی گلههای مذکور در دو منطقهی مختلف قرار داشتند. در بررسیهای کالبدگشایی، کبدها زرد و بزرگ شده بودند و نقاط خونریزی پتشی در سطح کبدها دیده شد. در گزارشی خداکرم و تفتی و همکاران، میزان شیوع IBH را در 20 درصد از یک گلهی 20000 قطعهای مرغ گوشتی در استان فارس بررسی کردند و حضور ویروس را در این استان تأیید نمودند.
در پژوهش میاحی و همکاران در سال 1398 در استان قم و مرکزی از 20 گله مورد بررسی 9 گله در آزمایش PCR از نظر آدنوویروس مثبت بودند که بالاترین میزان آلودگی IBH نسبت به سایر مناطق ایران میباشد. جدایههای بدست آمده در این مطالعه از گونه D سروتیپ 11 و از گونه E سروتیپ 8b بودند. این پژوهش، ردیابی مولکولی آدنوویروس و بررسی هیستوپاتولوژی جراحتهای کبدی جوجههای گوشتی در موارد مشکوک به هپاتیت ویروسی دارای گنجیدگی در استان های مرکزی و قم بوده است.
در سال 2018 میاحی و همکاران وقوع بیماری IBH را در استان خوزستان در گلههای گوشتی که ناشی از سروتیپ FAdV-11 بوده گزارش کردند.
در سال 2018 اولین گزارش وقوع بیماری IBH در گلههای گوشتی استان گلستان توسط حسینی و همکاران گزارش گردید و عامل ایجاد کننده سروتیپ FAdV-8b اعلام گردید.
در سال 2019 قلیان چی، حسینی و همکاران شیوع بیماری IBH را در گله گوشتی کشور که ناشی از سروتیپ FAdV-11 بود را گزارش نمودند که این گزارش مبتنی بر آنالیز فیلوژنتیکی و خصوصیات ژنوم کامل بر مبنای سکانس ژنی ویروس انجام گردید.
دکتر باسامی و همکاران در سال 2013 سروتیپ های FAdV-2 و FAdV-11 را از گلههای گوشتی مبتلا به ضایعات کبدی و سندرم تنفسی جداسازی کردند.
در سال 2015 رحیمی و همکاران وقوع بیماری در یک گله گوشتی در استان کرمانشاه گزارش نمودند.
همچنین مرشد و همکاران در سال 2017، 24 جدایه آدنوویروس را از گلههای گوشتی و مادر گوشتی 7 استان مختلف کشور شناسایی و تعیین هویت نمودند که تمامی آنها نیز از گونه D سروتیپ 11 و یا از گونه E سروتیپ 8b بودند.همچنین بر اساس نمونه های ارسالی از ادارات کل دامپزشکی استان ها به مرکز ملی تشخیص،آزمایشگاه های مرجع و مطالعات کاربردی و بر مبنای آزمایشات انجام شده اکثر نمونه ها آلوده به سروتیپ های متعلق به گروه ژنوتیپی D,E آدنوویروس مرغی بودند.
اقدامات مدیریتی
آوی آدنوویروس ها نسبت به غیرفعال شدن مقاوم می باشند، اما میتوان با کنترل شرایط محیطی و بهداشتی و غیرقابل نفوذ کردن سطوح و دیوارها به نفوذ هوا، آنها را حذف کرد. به دلیل انتقال از طریق تخم مرغ FAdV باید اقدامات مناسب برای جلوگیری از انتقال عمودی در گلههای مادر را از سنین ابتدایی آغاز کرد. اگرچه تجربه در گلههای عاری از پاتوژن اختصاصی نشان میدهد که انتقال افقی نیز به عنوان یک مشکل اساسی است و عاری نگه داشتن جوجههای عاری از پاتوژن اختصاصی از FAdV کار سختی است. به دلیل این که عفونتهای ناشی از بیماری بورس عفونی و کم خونی جوجه به عنوان عاملی برای افزایش عفونت FAdV محسوب میشود، بنابراین کنترل این بیماریها نیز در کنترل ویروس بسیار مهم است.
حساسیت نسبت به عوامل فیزیکی و شیمیایی
تمامی آدنوویروسهای پرندگان که تا به حال مطالعه شدهاند، خصوصیات معمول آدنوویروسها را نشان میدهند. آدنوویروسها به حلال های چربی مانند اتر و کلروفرم، سدیم دی اکسی کلات، تریپسن، فنل 2 درصد و الکل 50 درصد مقاوم هستند. آنها به تغییرات PH بین 3 تا 9 مقاوم هستند اما در فرمالدئیدها 1000:1 غیرفعال میشوند. این ویروس در برابر مهار کنندههای DNA مثل IUdR و BUdR مهار میشود؛ اگرچه این موضوع پذیرفته شده است که به صورت معمول آدنوویروسها در محلول مایع به مدت 30 دقیقه و در دمای 56 درجه سانتی گراد غیرفعال میشود و مقاومت به گرما در حضور یونهای دو ظرفیتی کاهش مییابد. FAdV خواص متنوعی دارد و برخی نسبت به حرارت بسیار مقاوم است؛ به صورتی که برخی از سویههای آن دمای 60 تا 70 درجه سانتی گراد را به مدت 30 دقیقه تحمل میکند. میزان عفونت زایی یک سویه از ویروس FAdV-1 در حرارت 56 درجه سانتی گراد بعد از 180 دقیقه کاهش پیدا میکند، اما یک سویه دیگر 18 ساعت در 56 درجه سانتی گراد زنده میماند، در حالی که این تفاوت در مقاومت در برابر حرارت به دلیل تفاوت در روش آزمایشگاهی نیست.
ایمنی
آوی آدنوویروس ها دارای آنتی ژن های اختصاصی گروه متفاوت از Siadenovirusو Atadenovirusمی باشند. تولید آنتی بادی های خنثی کننده به دنبال عفونت اتفاق می افتد و آنتی بادی ها یک هفته بعد از عفونت قابل تشخیص می باشند. بیش ترین تیتر آنتی بادی 3 هفته بعد مشاهده می شود.
پرنده به عفونت مجدد، 45 روز بعد از درگیری اولیه مقاوم، ولی علیرغم وجود آنتی بادیهای خنثی کننده و ترسیب دهنده، به عفونت مجدد، 8 هفته بعد از عفونت اولیه، حساس است. بیش ترین میزان دفع ویروس توسط پرنده در سن 5/2، 5/4 و 5/7 ماه است که مطابق با نظریه حضور ایمنی موضعی تا 8 هفتگی است. بنابراین مقاومت در برابر درگیری میتواند هم به مدت کم با ایمنی موضعی و هم به صورت اصلی توسط آنتی بادیهای موجود در گردش خون که از نفوذ ویروس به اندامهای داخلی جلوگیری میکند صورت گیرد. ارتباط ظاهری موجود بین آنتی بادیهای گردش خون و توقف دفع ویروس به احتمال زیاد به دلیل گسترش هم زمان هر دو ایمنی موضعی، که زودگذر است، و ایمنی هومورال که ماندگارتر است صورت میگیرد.
واکسیناسیون
به دلیل احتمال نقش بعضی از ژنوتیپ ها در ایجاد عفونت اولیه، واکسیناسیون اولیه باید بر مبنای آن ها انجام گیرد. با در نظر داشتن انتقال عمودی آدنوویروسها، باید واکسیناسیون با هدف رسیدن به یک میزان تیتر آنتی بادی در گلههای مادر باشد تا برای نتاج محافظت کننده باشد.
واکسیناسیون گلههای اجداد با واکسن کشته حاوی سویههای FAdV-D و FAdV-E در هفته 10 و 17 میتواند از نتایج به صورت کامل محافظت کند. بر اساس گزارشی از استرالیا واکسیناسیون گله مادر با واکسن سویهی FAdV-8b، می تواند از نتاج محافظت کند.
مدت کوتاهی بعد از اولین گزارش سندرم هیدروپری کاردیوم، واکسن حاوی بافت کبد همگن جوجههای مبتلا به صورت تجربی در پاکستان برای کنترل سندرم هیدروپری کاردیوم با موفقیت استفاده شد. واکسنهای تهیه شده بر پایه کشت بافت و تخم مرغ جنیندار بعدها به کار برده شد.
به دلیل اینکه مدارکی مبنی بر انتقال IBH از طریق مادر به نتاج در سیستم زنجیرهای وجود دارد، بنابراین کنترل ویروس IBH را باید از گلههای مادر از سنین ابتدایی آغاز کرد. با در نظر گرفتن انتقال عمودی ایمنی، باید واکسیناسیون جهت رسیدن به سطح تیتر آنتی بادی در گلههای مادر به صورتی انجام شود که تیتر انتقالی به نتاج در آنها محافظت کننده باشد.
مشاهده شده است که آنتی بادیهای مادری که به واسطه دو بار واکسیناسیون مولدین با واکسن کشته شده ایجاد گردیده بود توانست از مرغهای گوشتی در مقابل عفونت IBH محافظت کند.
شایان ذکر است که اپتیموم آنتی ژن در واکسنهای روغنی ساخته شده بین 105.5-107 TCID50 بررسی هر دز از واکسن بایستی در نظر گرفته شود.
تحقیقات نشان داده است که سروتیپ FAdV-8a پاتوژنیسته کمتری در مقایسه با FAdV-8b و FAdv11 دارد. همچنین بین این دو سروتیپ محافظت متقاطع وجود ندارد ولی سروتیپ FAdV-8a محافظت متقاطع با سروتیپهای FAdV-8b و FAdV-11 دارد.
واکسن دوگانه کشته حاوی سروتیپ های FAdV-4، FAdV-8b برای جلوگیری از بروز بیماری IBH در نتاج در گله های مادر گوشتی در کشورهای آمریکای جنوبی و زلاندنو مورد استفاده قرار می گیرد.
واکسناسیون با این واکسن بطور معمول در 8 و 12 هفتگی انجام می شود و بایستی بین تزریق واکسن حداقل چهار هفته فاصله باشد.
با توجه به تحقیقاتی که در کشور کره جنوبی انجام گرفته نشان داده شده است که واکسن کشته حاوی سروتیپ FAdV-4 بطور کامل گله های مادر گوشتی و نتاج حاصله را در مقابل سروتیپ FAdV-8a، FAdV-11 محافظت می کند. همچنین واکسن کشته حاوی سروتیپ FAdV-4 به طور قابل ملاحظه ای در برابر سروتیپ های FAdV-4، FAdV-8b محافظت ایجاد می نماید که این موضوع با انجام آزمایش چالنج نیز به اثبات رسیده است.
بعضی از کشورهایی که در حال حاضر واکسن IBH را مورد استفاده قرار می دهند عبارتند از : اسپانیا، استرالیا، زلاندنو، چین، مالزی، کره جنوبی، تایلند، بنگلادش، هند، پاکستان، مصر، اندونزی، کشورهای آمریکای جنوبی از جمله مکزیک، پرو، اکوآدور و شیلی.
نتیجه گیری
با تأیید حضور ویروس عامل IBH در استان های مختلف کشور و خسارات حاصله به صنعت طیور کشور و انتقال عمودی بیماری باید برنامه پیشگیری و کنترل بیماری در سطح فارم های مادرگوشتی و جوجه گوشتی با استفاده از روش واکسیناسیون در فارم های مادرگوشتی با استفاده از واکسنهای کشته انجام گیرد تا ضمن پیشگیری از بیماری در گله مادر با انتقال آنتی بادی به نتاج حاصله جوجه های گوشتی تا سن حدود 42 روزگی نسبت به بیماری مقاوم باشند. شایان ذکر است که واکسن های مورد استفاده حداقل بایستی دارای دو سروتیپ FAdV-8 و FAdV-11 باشند.لذا استفاده از واکسن مذکور در دستور کار دفتر بهداشت و مدیریت بیماری های طیور،زنبورعسل و کرم ابریشم قرار دارد.



Leave a Comments